Selección genética de la raza Frisona: Marcadores genéticos asociados a la paratuberculosis bovina
Artículo técnico publicado en la revista Frisona Española 266 (mar-abr 2025)
Resumen del estudio en el que se revisan los últimos esfuerzos realizados en NEIKER para identificar animales menos susceptibles y más resistentes a la paratuberculosis bovina y para generar una herramienta bioinformática predictiva que permita estimar el riesgo que al nacimiento presenta un animal de padecer la paratuberculosis o de ser resistente a ella.
La paratuberculosis bovina
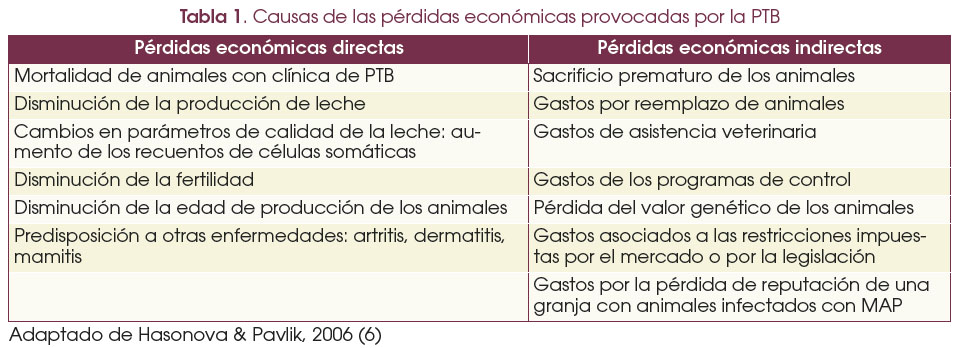
La PTB, también conocida como enfermedad de Johne, es una enfermedad infecciosa crónica causada por Mycobacterium avium subespecie paratuberculosis (MAP). Afecta principalmente a rumiantes domésticos y silvestres, con un impacto significativo en los bovinos lecheros debido a las pérdidas económicas asociadas a la disminución de la producción lechera, con una reducción media de 452 kg por lactación, la pérdida de peso y la mortalidad. Además, la calidad de la leche se ve afectada negativamente, evidenciando un aumento en el recuento de células somáticas y una disminución en la cantidad de grasa y proteína láctea. Además. la pérdida de peso en los animales infectados afecta a su rendimiento general, lo que se traduce en un menor peso al destete y sacrificio y menor valor de la canal.
Asimismo, la enfermedad incrementa los costes veterinarios y de manejo, debido a la necesidad de tratamientos continuos y control riguroso. La fertilidad también se ve comprometida, con un mayor intervalo entre partos, una mayor tasa de abortos y dificultades en el parto.
La PTB es una enfermedad de distribución mundial; se estima que afecta a más del 50 % de las explotaciones de bovino en Europa y Estados Unidos, donde las pérdidas económicas se estiman en 198 millones de dólares anuales, mientras que en la Unión Europea ascienden a 364 millones de dólares. En España, las pérdidas anuales debidas a la PTB se estiman en 12 millones de dólares, de modo que se sitúa, junto a Alemania y Japón, como uno de los países que notifican más casos a la Organización Mundial de Sanidad Animal (OMSA).
La transmisión de MAP se produce principalmente por vía fecal-oral, cuando los animales ingieren alimentos, leche o agua contaminados con heces de animales infectados. Los animales jóvenes son más susceptibles y, aunque los signos clínicos pueden tardar de 2 a 5 años en manifestarse, eliminan MAP en las heces, calostro y leche, y, por lo tanto, transmiten la enfermedad a otros animales en la ganadería. En animales adultos, los signos clínicos están asociados a una enteritis granulomatosa crónica que afecta principalmente a los últimos tramos del intestino delgado, yeyuno e íleon, y a los linfonodos asociados; incluyen diarrea crónica, pérdida de peso progresiva y, finalmente, la muerte del animal infectado. La infección es predominantemente subclínica; por cada animal con signos clínicos, al menos otros 25 pueden estar infectados y no ser detectados con las técnicas diagnósticas tradicionales. Una vez ingerido, MAP cruza la mucosa intestinal y es fagocitado por los macrófagos subepiteliales. Para evitar la supervivencia de MAP en el interior de los macrófagos infectados, los linfocitos Th1 del hospedador producen interferón-gamma (IFNγ), el cual está implicado en la activación y reclutamiento de macrófagos al sitio de la infección con la consiguiente producción de citoquinas proinflamatorias, interleucina 12 y factor de necrosis tumoral. La respuesta inmune de tipo celular mediada por IFNγ es clave en el control de las infecciones intracelulares como la causada por MAP, cuyo potencial zoonósico es preocupante.
 Diferentes estudios sugieren una asociación entre esta enfermedad y otras afecciones gastrointestinales y autoinmunes humanas, como la enfermedad de Crohn, la esclerosis múltiple, la diabetes tipo 1 y la artritis reumatoide. Este hecho, sumado a la posibilidad de que MAP pueda transmitirse al ser humano a través del agua y la leche contaminadas, ha hecho que algunos países adopten una actitud preventiva bloqueando la comercialización de leche proveniente de explotaciones con casos de PTB. Estas restricciones para la exportación a terceros países de productos derivados pueden suponer un problema para la industria y un importante retroceso económico.
Diferentes estudios sugieren una asociación entre esta enfermedad y otras afecciones gastrointestinales y autoinmunes humanas, como la enfermedad de Crohn, la esclerosis múltiple, la diabetes tipo 1 y la artritis reumatoide. Este hecho, sumado a la posibilidad de que MAP pueda transmitirse al ser humano a través del agua y la leche contaminadas, ha hecho que algunos países adopten una actitud preventiva bloqueando la comercialización de leche proveniente de explotaciones con casos de PTB. Estas restricciones para la exportación a terceros países de productos derivados pueden suponer un problema para la industria y un importante retroceso económico.
Por su impacto sanitario y socio-económico, la PTB es considerada una enfermedad de declaración obligatoria según lo establecido en el Reglamento 2016/429, respaldado por la OMSA y la Autoridad Europea de Seguridad Alimentaria (EFSA). Asimismo, ha sido categorizada como una enfermedad de "Categoría E" de acuerdo con el Reglamento de Ejecución (UE) 2018/1882, por lo que se trata de una enfermedad objeto de vigilancia. Sin embargo, a pesar de su relevancia, la PTB no está sometida a un programa de control oficial en nuestro país.
Esto se debe principalmente a la falta de directrices comunes para su control, así como a la dificultad para detectar a los animales infectados en las etapas iniciales de la infección y a animales subclínicos, con las herramientas diagnósticas disponibles.
Diagnóstico y control de la paratuberculosis bovina
 No existe un tratamiento eficaz para esta enfermedad, y la vacunación está prohibida en el ganado bovino en la mayoría de los países, debido a su interferencia con el diagnóstico de la tuberculosis bovina. Por ello, el control de la PTB se realiza eliminando animales positivos a las técnicas de diagnóstico (estrategia “test and cull”) e instaurando medidas higiénico-sanitarias y de bioseguridad en las ganaderías dirigidas a evitar que los animales más susceptibles, generalmente los menores de 1 año, entren en contacto con las heces de los animales infectados. En regiones con baja prevalencia, se emplea la estrategia test-and-cull para identificar y sacrificar periódicamente a los animales infectados. Aunque esta estrategia reduce la transmisión de MAP y disminuye la prevalencia de la enfermedad, su implementación puede ser cos-tosa y no garantiza la erradicación a largo plazo. Por lo tanto, se combina con prácticas de manejo y bioseguridad, las cuales se centran principalmente en evitar la exposición de la recría a MAP. Los programas de control de la PTB bovina existen desde principios del siglo XX, aunque su aplicación ha sido heterogénea. Los principales países europeos productores de leche, como Alemania, Países Bajos o Italia, entre otros, cuentan con programas de control establecidos. Sin embargo, en España solo existen programas de control voluntarios de carácter autonómico.
No existe un tratamiento eficaz para esta enfermedad, y la vacunación está prohibida en el ganado bovino en la mayoría de los países, debido a su interferencia con el diagnóstico de la tuberculosis bovina. Por ello, el control de la PTB se realiza eliminando animales positivos a las técnicas de diagnóstico (estrategia “test and cull”) e instaurando medidas higiénico-sanitarias y de bioseguridad en las ganaderías dirigidas a evitar que los animales más susceptibles, generalmente los menores de 1 año, entren en contacto con las heces de los animales infectados. En regiones con baja prevalencia, se emplea la estrategia test-and-cull para identificar y sacrificar periódicamente a los animales infectados. Aunque esta estrategia reduce la transmisión de MAP y disminuye la prevalencia de la enfermedad, su implementación puede ser cos-tosa y no garantiza la erradicación a largo plazo. Por lo tanto, se combina con prácticas de manejo y bioseguridad, las cuales se centran principalmente en evitar la exposición de la recría a MAP. Los programas de control de la PTB bovina existen desde principios del siglo XX, aunque su aplicación ha sido heterogénea. Los principales países europeos productores de leche, como Alemania, Países Bajos o Italia, entre otros, cuentan con programas de control establecidos. Sin embargo, en España solo existen programas de control voluntarios de carácter autonómico.
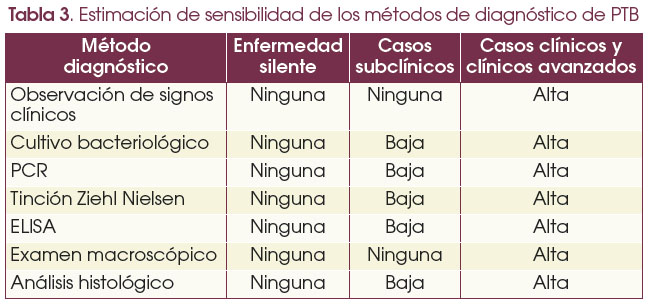
Las técnicas de diagnóstico disponibles son el ELISA para la detección de anticuerpos anti-MAP en el suero de los animales infectados y la reacción en cadena de la polimerasa (PCR) para la detección de ADN de MAP en heces, que presentan problemas para la detección de animales subclínicos o en etapas iniciales de la infección por MAP. Estas técnicas, sin embargo, no son suficientemente sensibles para detectar animales infectados que no muestran signos de enfermedad y en los que la carga bacteriana y los niveles de anticuerpos producidos están por debajo de los niveles de detección.
El método diagnostico ideal, cada vez más necesario, tiene que ser rápido y sensible de tal forma que permita a los ganaderos asegurarse de que los animales que compra están libres de infección y de que las reproductoras no están infectadas y no transmiten la infección a los terneros.
¿Es posible seleccionar animales menos susceptibles y más resistentes a la PTB bovina?
 La PTB es una enfermedad multifactorial que se produce como resultado de la interacción de factores microbianos, genéticos, y ambientales.
La PTB es una enfermedad multifactorial que se produce como resultado de la interacción de factores microbianos, genéticos, y ambientales.
La genética específica de cada animal es uno de los factores más importantes implicados en la resistencia a la infección por MAP, por lo que una de las estrategias de control más comúnmente aceptada es la que se basa en la selección de aquellos animales menos susceptibles y más resistentes a la infección por MAP.
NEIKER ha llevado a cabo un análisis de asociación a genoma completo (genome-wide association studies, GWAS) utilizando datos de genotipado de unas 1.000 vacas frisonas y fenotipos pre-mortem (ELISA para la detección de anticuerpos frente a MAP) y postmortem (PCR y cultivo de tejido para la detección de MAP, y análisis histopatológico de lesiones intestinales). En un primer estudio, la combinación de ELISA-PCR-cultivo (h2 = 0.139) permitió identificar 398 SNPs asociados a la susceptibilidad a la infección por MAP. En un segundo estudio se identificaron un total de 449 y 752 SNPs asociados con la presencia de lesiones multifocales (h2 = 0.057) y difusas (h2 = 0.189), respectivamente.
Mediante análisis de varianza, se estimó que la genética explicaba entre el 7 al 87 % de las diferencias entre animales, siendo los caracteres de resistencia como la reducción de la carga bacteriana en los macrófagos de animales infectados y la producción de IFNγ, los caracteres con h2 más altas, h2= 87 % y h2= 64 %, respectivamente.
NEIKER se encuentra ahora en el momento idóneo para, en colaboración con CONAFE, emplear estos marcadores genéticos en la categorización y selección de animales menos susceptibles y más resistentes a la PTB para las diferentes realidades productivas del sector lechero en España.
Desarrollo de una herramienta bioinformática predictiva
De hecho, NEIKER y CONAFE, en colaboración con el Departamento de Mejora Genética Animal del INIA, han desarrollado una herramienta informática predictiva e integrada que permite estimar valores de selección (Genomic Estimated Breeding Values, gEBVs) o valores de riesgo poligénico. Estos gEBVs se pueden usar para catalogar, ordenar y seleccionar a vacas y toros de la raza frisona pertenecientes a cualquier población y genotipados con el chip de media densidad (MD) EuroG de acuerdo a los caracteres de susceptibilidad y resistencia a la infección por MAP. Es decir, cualquier animal genotipado con el chip EuroG MD puede ser evaluado para su potencial genético de mayor o menor susceptibilidad y resistencia a la PTB en función de las variantes alélicas que porte, aunque no se le haya realizado ningún tipo de analítica o análisis laboratorial.
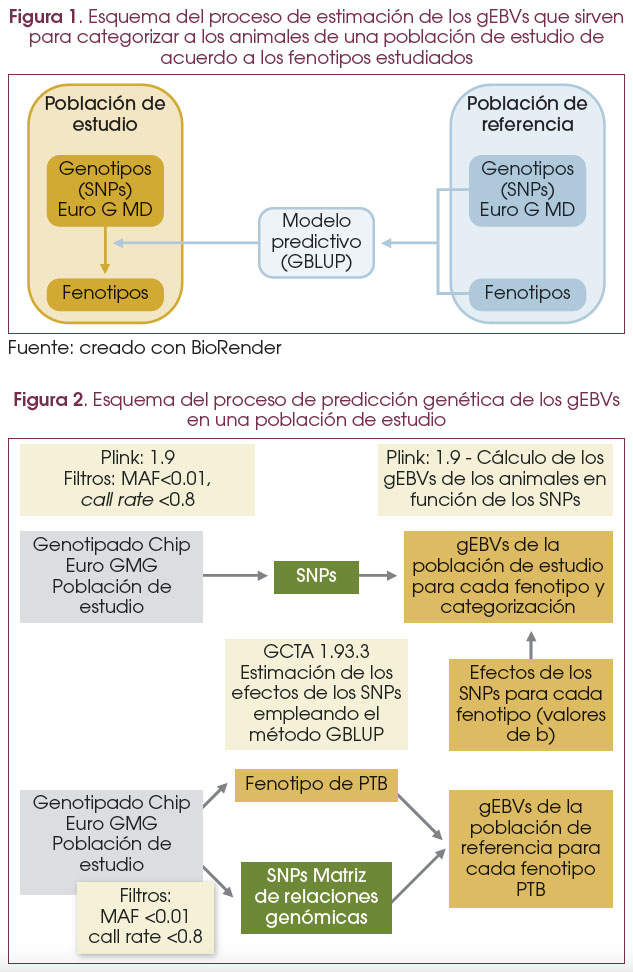 En la Figura 1 se describen brevemente los datos que emplea la herramienta y en qué consiste. A partir de las variantes alélicas obtenidas con el chip EuroG MD de la población de referencia y sus datos fenotípicos (medidas o datos cualitativos) para cada carácter analizado se genera un modelo lineal predictivo (Genomic Best Linear Unbiased Prediction, GBLUP) que permiten estimar los gEBVs de la población de estudio.
En la Figura 1 se describen brevemente los datos que emplea la herramienta y en qué consiste. A partir de las variantes alélicas obtenidas con el chip EuroG MD de la población de referencia y sus datos fenotípicos (medidas o datos cualitativos) para cada carácter analizado se genera un modelo lineal predictivo (Genomic Best Linear Unbiased Prediction, GBLUP) que permiten estimar los gEBVs de la población de estudio.
En la Figura 2 se describe en más detalle el funcionamiento de la herramienta. A partir de las variantes alélicas de los animales de la población de referencia obtenidas con el chip EuroG MD, se filtran los SNPs con una frecuencia del alelo menor por debajo del 0,01 y que no aparecen en al menos el 80 % de los animales (call rate < 0.8) empleando el software Plink1.9. A partir de las medidas o datos cualitativos (positivo o negativo) de cada carácter analizado y los variantes alélicas de la población de referencia filtradas, se calculan los gEBVs en la población de referencia y se genera una matriz de relaciones genómicas empleando el modelo predictivo GBLUP del software GCTA1.93.2. (19). La matriz y los gEBVs se utilizan para determinar el efecto (valor de b) de cada SNP asociado a cada carácter. Los valores de b de cada SNP se utilizan posteriormente para predecir los gEBVs de cualquier población conociendo únicamente las variantes genéticas que porta en los SNPs asociados. A partir de las variantes alélicas de los animales de la población de estudio obtenidas con el chip EuroG MD, se filtran los SNPs con una frecuencia del alelo menor por debajo del 0.01 y con call rate <0.8 y se identifican las variantes que previamente habían mostrado asociación en la población de referencia. A continuación, se calculan los gEBVs de la población de estudio empleando el software Plink1.9. Los pasos que implica el proceso desde que se obtienen los datos de genotipado hasta que se catalogan los animales se agilizaron empleando comandos de R para acabar por generar una herramienta bioinformática integrada.
Además de los modelos lineales, en la fase de optimización de la herramienta se testaron otros modelos, pero debido a que el modelo lineal requería un menor tiempo computacional, fue el que se decidió finalmente incluir en la herramienta.
Por último, se genera un informe que incluye los gEBV para los dos caracteres de susceptibilidad evaluados (positividad a ELISA, PCR y cultivo de MAP, presencia de lesiones difusas) y dos de resistencia a la infección por MAP (reducción de la carga en macrófagos, producción de IFNγ). Se modifica el signo de los gEBVs de todos los caracteres menos para la producción IFNγ, de forma que los gEBVs más altos sean los más favorables y se relacionen en todos los casos con resistencia a menor probabilidad de presentar lesiones difusas y de dar positivo a los test diagnósticos y mayor capacidad para reducir la carga de MAP en macrófagos y de producir más IFNγ. En función de los cuartiles en los que se encuentran los gEBVs de un animal para estos cuatro caracteres se categoriza como (+), (–) o (0). Un animal se considera (+) cuando sus valores de gEBVs se encuentran en el cuartil más alto para tres de los cuatro caracteres. Por el contrario, se categoriza como (–) cuando se encuentra en el cuartil más bajo para tres de los cuatro caracteres. El resto de animales se clasifica como (0). Empleando la herramienta bioinformática desarrollada, se categorizaron unos 5.358 machos y hembras de raza frisona seleccionados entre los genotipos disponibles para formar una población representativa de la raza y presente en las genealogías de la población activa actual. Aproximadamente el 5,5 % de los animales de esta población eran (+) y el 5,5 % (–), siendo el 88,8 % de la población (0). También se observó que los padres (–) no tienen hijos (+) y que los padres (+) apenas tienen hijos (–). CONAFE cederá a cada ganadero que genotipe sus animales con el chip de EuroG MD de Eurogenomics la categorización de los mismos de acuerdo a sus gEBVs, de manera que pueda tomar decisiones relacionadas con desviejes o con selección de las mejoras reproductoras.
Inclusión de la resistencia a la paratuberculosis en el programa de cría de la raza frisona española y beneficios esperables
Históricamente, la mejora genética en vacuno lechero ha estado orientada a incrementar la producción de leche, tanto en cantidad como en calidad. En la actualidad, hay un interés creciente en incluir nuevos caracteres funcionales entre los objetivos de selección. La mayoría de los países europeos, USA y Canadá ya incorporan la resistencia genética a la mamitis y a otras enfermedades en sus programas de selección genética. Países como Reino Unido y Francia han incorporado reciente-mente la resistencia genética a la tuberculosis y a la PTB bovina, respectivamente. En España, caracteres funcionales como la longevidad y el número de días abiertos se han incorporado en los índices de selección como el índice genético combinado (ICO). También se incluyen caracteres relacionados con la salud animal como el recuento de células somáticas para evitar problemas de mamitis, otra de las enfermedades que causa mayores pérdidas económicas al ganadero, y el índice de salud podal que nos indica la resistencia de los animales a las cojeras por enfermedades en las pezuñas. El presente y el futuro de la mejora genética del vacuno de leche pasa sin duda por su estudio genómico, incorporando nuevos marcadores a los actuales índices de selección genética.
NEIKER se ha comprometido a promover la participación activa de ganaderos y otros actores del sector en el desarrollo y validación de la nueva herramienta bioinformática, garantizando la formación de los actores y la practicidad y utilidad de la herramienta desarrollada en condiciones reales. Para este objetivo, NEIKER, en colaboración con CONAFE ha obtenido financiación en el marco de grupos operativos supraautonómicos 2024 para el proyecto INMUNOGEN* de la Asociación Europea para la Innovación en materia de productividad y sostenibilidad agrícolas (AEI-Agri), en el marco del Plan Estratégico de la PAC 2023-2027.

Beneficios esperables
Se espera mejorar la inmunocompetencia de los animales, no solo frente a la PTB sino también frente a otras enfermedades, disminuyendo la necesidad de tratamientos con antibióticos. Esto redundará en una mejora de la salud, la longevidad y el bienestar animal, así como en la reducción de las pérdidas económicas que soportan las explotaciones ganaderas ocasionadas por los desviejes prematuros y el descenso de la productividad, y las causadas por el elevado costo de las medidas de saneamiento, que son las únicas de las que se dispone actualmente para el control de la PTB. De esta forma, la reposición recaerá en las novillas sanas, productivas y de alta resiliencia a enfermedades de la propia explotación. Esto redundará en una mejora de la eficiencia productiva de la ganadería y unos mayores beneficios, al ser capaces de aumentar el número de lactaciones por animal y reducir el remplazo.
Al detectar y seleccionar a los animales más resistentes al nacimiento, se puede minimizar el desperdicio de recursos alimenticios e hídricos que, de otro modo, se destinarían a animales enfermos. La mejora de la eficiencia en la producción ganadera es un aspecto crucial, especialmente cuando nos enfrentamos a una enfermedad crónica como la PTB, que daña seriamente la productividad de las explotaciones. Además, al mejorar la salud general del ganado, se disminuye la necesidad de recursos adicionales para compensar la pérdida de producción debido a enfermedades.
Al disminuir el impacto productivo, minimizar la necesidad de tratamientos médicos y el uso de recursos naturales, se reduce la huella ambiental general de la industria ganadera, contribuyendo así a mitigar el cambio climático y sus efectos adversos. Garantizar la salud de los animales de producción asegura la generación de alimentos seguros y de mayor calidad para la población. Por otro lado, al contribuir directamente al control de la PTB mediante la mejora de la inmunocompetencia general de los animales, se contribuye de forma indirecta al control de otras enfermedades, se reduce la propagación de enfermedades zoonósicas, protegiendo así la Salud Pública y minimizando el riesgo de transmisión de enfermedades entre animales y humanos. Además, la PTB impone restricciones en los mercados internacionales para la exportación de animales y productos lácteos. Abordar el control de esta enfermedad mediante estrategias de mejora genética mejorará la competitividad del sector ganadero, permitiendo el acceso a nuevos mercados y generando beneficios económicos directos para el país, lo que repercutirá positivamente en la calidad de vida de los ciudadanos. Al mejorar la salud y productividad de los rebaños, se espera un aumento en los ingresos y la rentabilidad de las ganaderías locales, lo que garantizará un suministro estable de productos lácteos y cárnicos seguros, fortaleciendo así la seguridad alimentaria y la demanda de alimentos a nivel mundial. Este incremento en la rentabilidad no solo alienta la permanencia de las familias en las zonas rurales al ofrecer oportunidades económicas más atractivas, sino que también puede estimular el relevo generacional, revitalizando el interés de los jóvenes por el sector agrícola y ganadero. Además, la introducción de nuevas tecnologías y prácticas no solo crea empleo y desarrolla habilidades técnicas en las áreas rurales, impulsando el desarrollo económico local, sino que también promueve prácticas ganaderas más sostenibles y un mejor bienestar animal, lo que refleja un compromiso ético y responsable con el medio ambiente. La mejora genética basada en la inclusión de marcadores genéticos de resistencia a enfermedades es un proceso a medio-largo plazo que depende de la presión selectiva que se le quiera dar al carácter, pero sus resultados son acumulativos y permanentes a través de generaciones, pudiendo conducir a la erradicación de enfermedades. En concreto, la selección de animales más resistentes a la infección por MAP beneficiaría especialmente a aquellas áreas geográficas donde la enfermedad es muy prevalente y donde la vacunación no está permitida por su interferencia con los métodos de diagnóstico de la tuberculosis bovina. Una posible futura certificación a cerca del estatus infeccioso respecto a esta enfermedad sería deseable desde todos los puntos de vista: de cara a ofrecer productos seguros al consumidor, obtener una posición privilegiada para la venta de animales y a la vez disponer de establos libres donde comprar animales.
Perspectivas
El Departamento de Sanidad Animal de NEIKER trabaja también en la identificación de variantes génicas asociadas a otras enfermedades. De hecho, recientemente se han identificado marcadores genéticos asociados a vacas de la raza frisona que son capaces de producir mayores niveles de IFNγ en respuesta a la PPDBOV, un derivado proteico de Mycobacterium bovis, el agente causante de la tuberculosis bovina. Asimismo, se investiga en variantes genéticas asociadas a la tuberculosis bovina en otras razas como la raza de lidia. Desde el punto de vista tecnológico, la aplicabilidad directa y preventiva de los marcadores genéticos identificados y validados por NEIKER permitirá el desarrollo de futuras aplicaciones, herramientas y soluciones innovadoras que posibiliten una detección más temprana y precisa de animales resistentes a la PTB, lo que facilitará la toma de decisiones en tiempo real y mejorará la gestión sanitaria del ganado.
Si quieres leer el artículo en PDF, puedes descargarlo desde este enlace o también desde "Documentos".
Artículo técnico publicado por Gerard Badia-Bringué1, José Antonio Jiménez2, Óscar González-Recio3, Marta Alonso-Hearn1en el número 266 de la revista Frisona Española, correspondiente a los meses de enero y febrero de 2025.
1 Dpto. de Sanidad Animal, NEIKER-Instituto Vasco de Investigación y Desarrollo Agrario, Basque Re- search and Technology Alliance (BRTA); 2 Dpto. Técnico de CONAFE; 3 Dpto. de Mejora Genética Animal, Instituto Nacional de Investigación y Tecnología Agraria y Alimentaria (INIA).
Enlaces
-
YoutubeSuscríbete al canal de YouTube de CONAFE - Frisona Española
-
FacebookSíguenos en la página en Facebook de CONAFE - Frisona Española
-
TwitterSíguenos en el Twitter de CONAFE - Frisona Española
-
InstagramSíguenos en el Instagram de CONAFE - Frisona Española